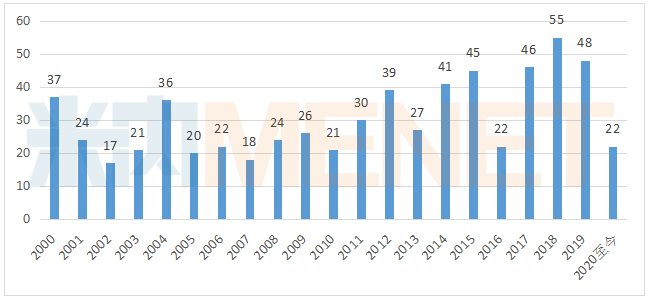
据美国FDA官网最新公布结果,5月FDA新药审批速度依旧给力,5月陆续批准了6款新药,这也是2020年至今批准新药最多的一个月份。2020年未过半载,FDA已经批准22款新药,预计全年获批的新药数量有望超过2019年。
图1:2000年至今FDA批准的新药数量
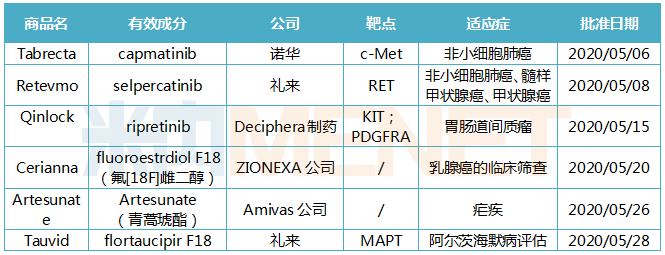
5月FDA批准的6款新药,全为新分子实体,也涉及多个疾病领域。Tabrecta是FDA批准的首款针对METex14突变转移性NSCLC的靶向疗法。可治疗3种瘤种的Retevmo是首款被FDA批准用于治疗携带RET基因改变的癌症药物。Qinlock是首款被FDA批准用于四线治疗胃肠道间质瘤的靶向药物。Artesunate是目前美国唯一一款批准用于治疗严重疟疾的药物。还有两款放射性诊断剂Cerianna、Tauvid,分别为乳腺癌的临床筛查和阿尔茨海默病评估提供重要帮助。
表1:FDA批准新药的详细信息
MET靶点重磅药物:
Tabrecta(capmatinib)
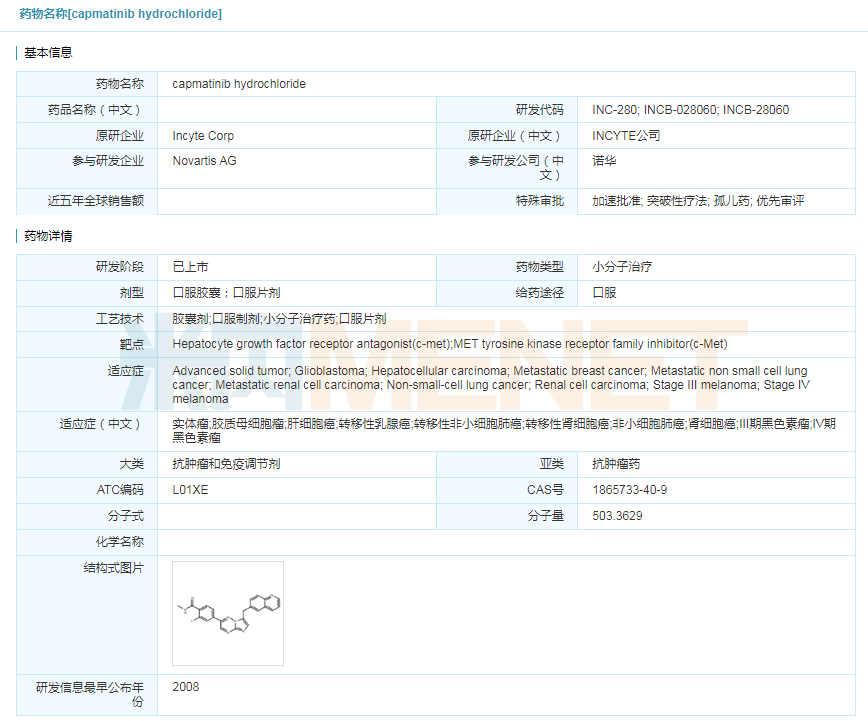 2020年5月6日,诺华宣布FDA加速批准Tabrecta(Capmatinib) 上市,用于治疗局部晚期或转移性MET外显子14跳跃(METEX 14)突变的非小细胞肺癌(NSCLC)患者。Tabrecta是FDA批准的首款、全球第二款针对METex14突变转移性NSCLC的靶向疗法。此前,Tabrecta获得了FDA授予的突破性疗法认定和孤儿药资格,其新药申请也获得了优先审评资格。
2020年5月6日,诺华宣布FDA加速批准Tabrecta(Capmatinib) 上市,用于治疗局部晚期或转移性MET外显子14跳跃(METEX 14)突变的非小细胞肺癌(NSCLC)患者。Tabrecta是FDA批准的首款、全球第二款针对METex14突变转移性NSCLC的靶向疗法。此前,Tabrecta获得了FDA授予的突破性疗法认定和孤儿药资格,其新药申请也获得了优先审评资格。
肺癌无论发生率还是死亡率,在全球范围内都“名列前茅”,而非小细胞肺癌是最常见的肺癌类型,约占所有肺癌病例的85%-90%。MET是癌症的驱动基因之一,在非小细胞肺癌中,带有MET突变的病例约占总数的3-4%。优异的临床试验数据为Tabrecta获批奠定坚实的基础。
数据表明,无论患者先前是否曾接受过治疗,Tabrecta均能带来显著治疗效果。在初治的患者中,Tabrecta的总缓解率为68%;在经治的患者中,Tabrecta的总缓解率为41%。两组患者的中位缓解持续时间分别是11.14个月和9.72个月。
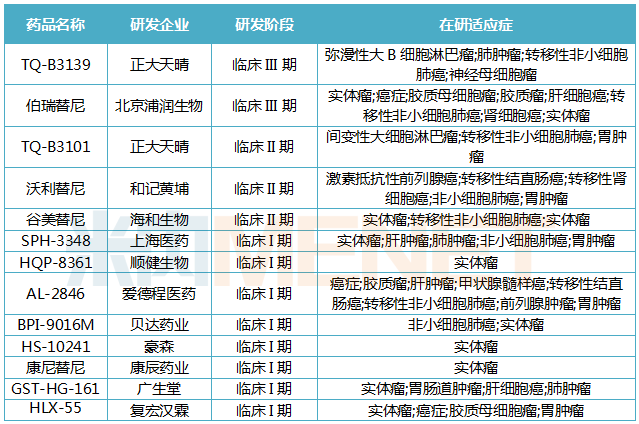
Tabrecta的活性成分capmatinib是一款口服MET抑制剂,可通过阻断MET基因的变异表达,从而有助于阻止肿瘤细胞的生长。目前,MET靶点被认为是癌症领域一颗冉冉升起的新星,国内多家药企已针对MET靶向药进行布局及开发。
表2:国内MET靶向药研发进展(不完全统计)
多瘤种新药:
Retevmo(selpercatinib)
2020年5月8日,FDA正式批准礼来子公司Loxo Oncology开发的Retevmo(selpercatinib),用于治疗3种癌症的患者,包括:治疗转移性RET融合阳性非小细胞肺癌(NSCLC)、晚期或转移性RET突变甲状腺髓样癌(MTC)和晚期或转移性RET融合阳性甲状腺癌。
Retevmo是首款被FDA批准用于治疗携带RET基因改变的癌症药物。此前,Retevmo已获得FDA授予的孤儿药、突破性药物、优先审查等资格。
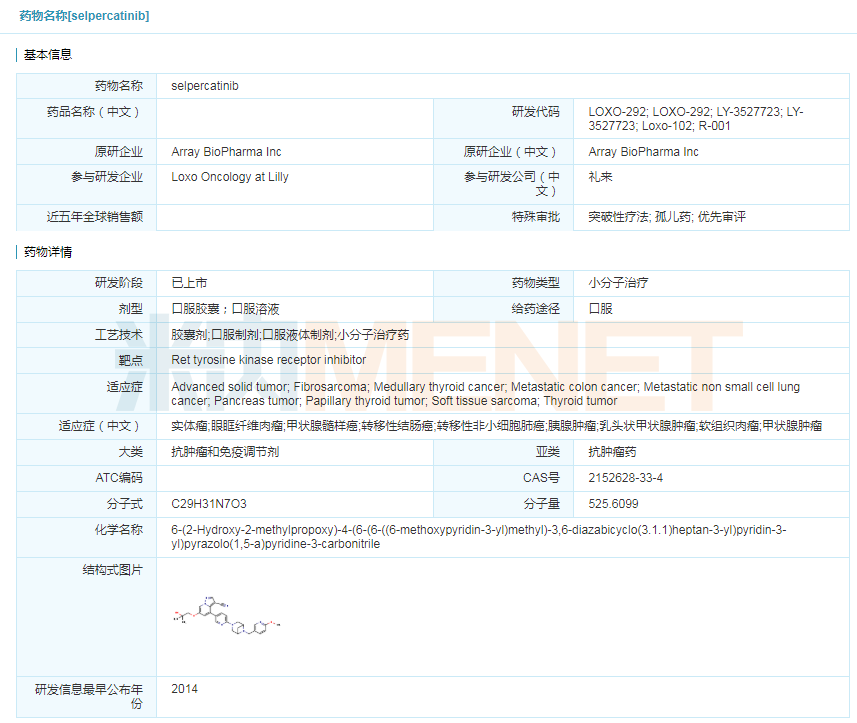
此次批准主要基于名为LIBRETTO-001的单臂多中心I/II期临床试验数据。该临床试验既纳入了初治患者,也纳入了经治的各种晚期实体肿瘤患者,通过客观缓解率(ORR)和中位缓解持续时间(DOR)两个终点指标评估Retevmo治疗存在RET基因改变的患者的疗效。
表3:Retevmo临床试验数据
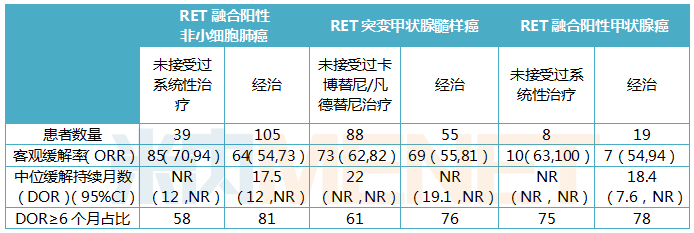
(注:NR为未达到)
Retevmo关于治疗非小细胞肺癌方面,105例经治患者的ORR为64%,81%的患者DOR≥6个月,39例初治的患者中,ORR为84%;在治疗甲状腺髓样癌方面,55例经治患者的ORR为69%,76%的应答患者DOR≥6个月,88例初治患者中,ORR为73%,61%的患者DOR≥6个月;在治疗RET融合阳性的甲状腺癌方面,19例接受过另一种系统疗法的甲状腺癌患者ORR为79%,87%的应答患者DOR≥6个月;8例未治的甲状腺癌患者中,ORR为100%,75%的应答患者DOR≥6个月。
GIST首款四线治疗:
Qinlock(ripretinib)
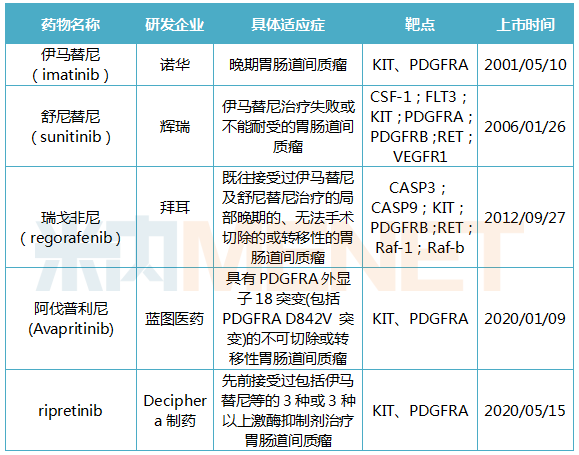
2020年5月15日,再鼎医药合作伙伴Deciphera的Qinlock(ripretinib)获得FDA批准上市,用于晚期胃肠道间质瘤(GIST)四线治疗。该药是首款被FDA批准用于四线治疗胃肠道间质瘤的靶向药物。Qinlock适用于先前接受过包括伊马替尼(imatinib)、舒尼替尼(sunitinib)、瑞戈非尼(regorafenib)在内的3种或3种以上激酶抑制剂治疗的成人患者。Qinlock的获批比目标行动日期提前了3个月,并曾获得FDA授予的突破性药物、孤儿药、快速通道、优先审查等资格。目前,该药也在中国申报临床试验。
胃肠道间质瘤是一种罕见的间叶源性肿瘤,其主要病因80%-90%是KIT基因突变,5%-10%是PDGFRA基因突变,导致酪氨激酶活化,细胞生长失控并发生癌变。在此之前,FDA共批准4种针对胃肠道间质瘤患者的靶向药物,但部分患者进行以上治疗后无反应,肿瘤继续发展,这种情况下Qinlock可以给患者带来新的希望。
Qinlock的有效性和安全性在名为INVICTUS的III期临床试验数据中得到验证。数据表明,接受Qinlock治疗的患者的中位无进展生存期(PFS)达到6.3个月,比对照组多出5.3个月。Qinlock将患者疾病进展或死亡风险降低85%,且Qinlock组患者中位总生存期为15.1个月,显著优于对照组(6.6个月),将患者死亡风险降低64%。
表4:FDA批准胃肠道间质瘤靶向药
放射性诊断剂:
Cerianna(fluoroestrdiol F18)
2020年5月20日,FDA批准Zionexa公司的放射性诊断剂Cerianna(fluoroestrdiol F18)上市,作为活检的辅助手段与正电子发射断层扫描(PET)成像共用,检测雌激素受体(ER)阳性的复发或转移性乳腺癌患者。PET造影剂Cerianna的获批,为乳腺癌的临床筛查提供又一选择。
fluoroestrdiol F18化学结构式
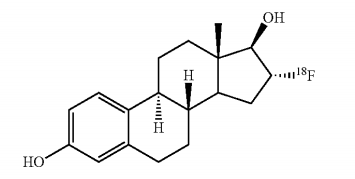
CERIANNA是一种无菌、澄清、无色的静脉注射溶液,其活性成分氟雌二醇F18(fluoroestrdiol F18)是一种合成的雌激素类似物。一项纳入了90名经组织学证实为浸润性乳腺癌的女性的临床试验数据为此次批准提供支持。数据结果通过评分方式得出结果,在47例活检阳性患者中,有36例影像学检查阳性;在38例活检阴性患者中,所有38例影像学均为阴性;11例影像学检查假阴性的患者中,有10例活检阳性。
青蒿琥酯抗疟:
Artesunate(Artesunate)
2020年5月26日,FDA宣布批准Amivas公司的青蒿琥酯(Artesunate)静脉注射剂用于治疗患有严重疟疾的成人和儿童。青蒿琥酯是目前美国唯一一款批准用于治疗严重疟疾的药物。此前,青蒿琥酯静脉注射剂还获得了FDA授予的孤儿药资格认定,新药申请也获得了优先审评资格。
Artesunate化学结构式
疟疾是一种由蚊子叮咬传播的寄生虫病,其流行程度和危险性一点都不亚于癌症等其他重大疾病。这是因为疟疾一旦变得严重,就会影响到中枢神经系统。据WHO估计,2018年,全球疟疾病例数超过2.2亿,约造成40.5万人死亡。
青蒿琥酯静脉注射治疗严重疟疾的安全性和有效性在两项临床试验中得到评估。亚洲进行的一项随机对照试验以及在非洲开展的一项支持性随机对照试验中,使用青蒿琥酯治疗的患者在院内死亡的人数均明显低于使用奎宁治疗的对照组患者。
阿尔茨海默病tau病理成像第一药:
Tauvid(flortaucipir F18)
2020年5月28日,礼来公司的放射性诊断剂Tauvid(flortaucipir F18)正式被FDA批准,用于大脑的正电子发射断层扫描(PET)成像,以评估脑中聚集的tau神经原纤维缠结(NFT)的密度和分布。Tauvid通过判断阿尔茨海默病(AD)的主要标志物之一——tau神经原纤维缠结,以帮助需要接受AD评估的认知障碍成人患者。这也是首款被FDA批准帮助对大脑中的tau病理进行成像的药物。
阿尔茨海默病是一种起病隐匿的进行性发展的神经系统退行性疾病,目前没有彻底治愈的药物,使用诊断成像可以帮助患者及其家人更好的规划未来。
此次批准主要基于两项临床研究的数据。第一项研究,独立病理学家对患者Tauvid脑扫描成像及患者死后大脑组织中NFTs的密度和分布进行了评估。两者之间的比较显示,解读Tauvid图像的评估者有较高几率正确判断存在tau病理的患者,评估无tau病理患者的准确率为中等到高。
第二项研究检测Tauvid评估者的解读与其他评估结果之间的一致性。解读完全吻合的一致性为1,而完全不吻合的一致性为0。在这一研究中,对所有241例患者的解读一致性为0.87。亚组分析表明,82例终末期疾病患者的一致性为0.82,159名认知功能障碍患者的一致性为0.90。
资料来源:FDA官网、企业公告、米内网数据库
注:如有错漏,敬请指正